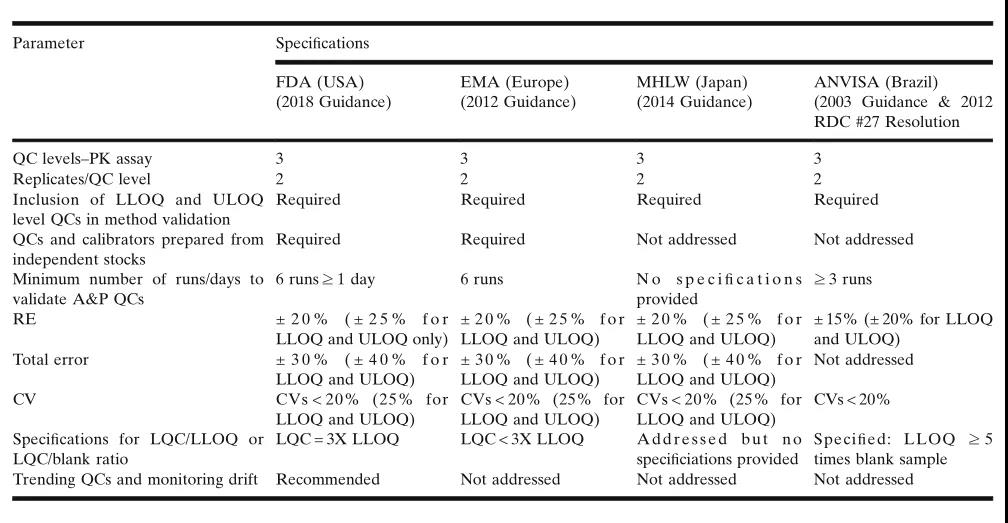
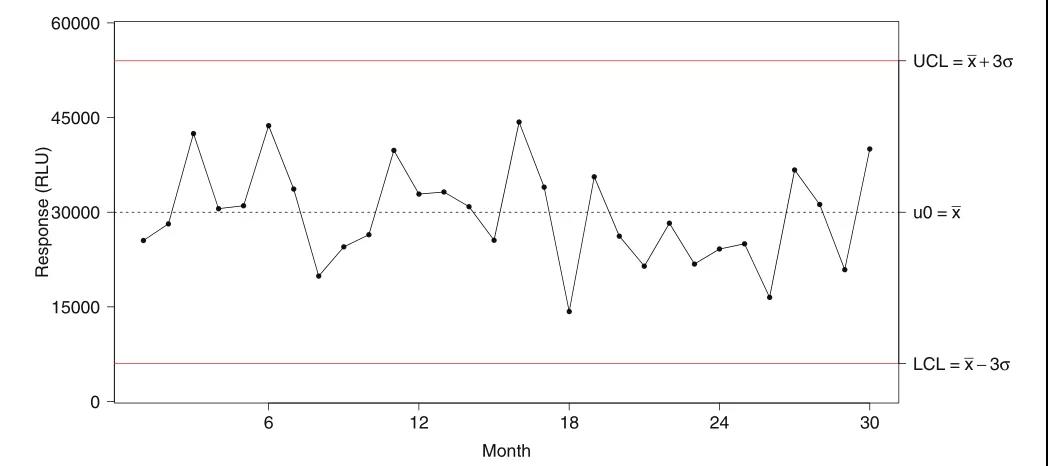
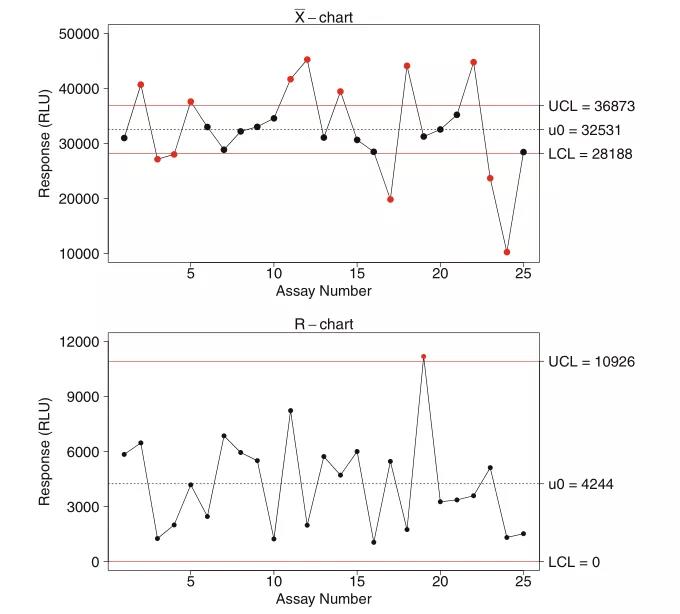
上个月,“袁来这样的”栏目阶段推荐了LBA中的效率操纵样本(QC,quality control)制备、企业认证(qualification)和院校代号保持完整性服务器维护的涉及凡路和实践操作方式 。上年将得以延续当期信息,重中之重就监管部门机购对QC的标准、关注QC的作用上升趋势、以防止定性分析漂移等等方面作过详细的详解。
“袁来远比”专刊系佛山合乐hl8官网药业徽信网络公示号打照的科普知识学术界专刊,资源均为合乐hl8官网药业子控股子公司北京博瑞总监主管袁智教授亿人。
表3.监管学校学校对使用在按量定性分析QC的规范要求之更。