

























上周末,“袁来这般”特刊就PK LBA这几个等级的方案核实机制做好了祥细简绍(,环绕着每个层面的效验中应鉴定的技术参数、对应的展开基准进行微信分享,上年将传承当期方面,接着分享一下事后相关方面。
word计录是大多数技术性能考核岗位流程图可相空间性的一位最重要构成的局部。
对待安全风险管控级安全查验的方式 ,详细完整和迅速的文本记录好时间是树立方式 可行性的一定要條件。是文本记录好时间的核心区介绍,原则操作的技术规程(SOPs)将规定安全风险管控级安全查验,收录是需要考评的方式 参数设置设置、每参数设置设置的容忍原则同时 个别于个别方式 的安全查验方案范文。程序编写个别详细方式 的SOP时,应以便该安全风险管控级安全查验后的方式 在钻研探讨中样板介绍一下的技术应用,同时还需要符合每钻研探讨周期结速时提交申请官方的介绍一下意见书单意见书。
关于科学实验级认证的步骤,其涉及word記錄表与监管机构级认证相对需要缩少,但一定要确定在探索前认证和探索中范本研究环节形成的数据显示的完全性和管用性。在任何环节完成任务时候,工诗人在通知单或汇报总结性文件夹中应記錄表各项鉴定的没想到。
就深入分析级手机安全查证的运作工作流程,其重要性表格文件記錄与监管机构级和物理学级手机安全查证相对需要提高认识骤减小,情况是的使用深入分析级手机安全查证的的方法其健康期较短,对其进行简约的表格文件記錄如要。
监察级:对於每种监督管理级证实,其涉及到的SOP应由简略介绍英文必要评定的策略指标、如果实行每种指标的评定、每种指标的接受了的原则及相当的证实文本。另外,还应在每种策略筹备三份确认的证实方案设计,出示与策略开展涉及到的的主要信心,是指介绍系统程序流程的描绘阐述、至关重要生化化学药品和非至关重要生化化学药品的目录、适用该的研究的生物数学家的目录、证实的原则方法系统程序流程的打算误差率及打算误差率的想法。全部文本都必要保管在平安的学习环境中。
合理级:应编撰三份具体实施科研前查证的进度表,首先需要计录待测评的因素以及其接收标准规定,且需要对每台的不同的方式所概念的主要因素参与测评,以抓实适量地推进探讨前头法证实通过通过。突然会需更庞杂的介绍准则,可结合低于几领域考量:(1)该项目的主要需;(2)客户法激发流程中沉淀的统计资料使用学科探索考评;(3)怎样才能巧用探讨中样板定性分析统计资料。若有关于技术参数和介绍准则是在证实通过通过以前受到,且在筹划中带来了了理论知识法律依据和考评时,则也是还不错介绍的。以及还不错写一种特地表述需考评的准则和学科探索级证实通过通过介绍准则的SOP为发生证实通过通过筹划的代换或增加。如何证实通过通过工作性与SOP中表述的准则不彻底一直时,那些在下达可以支持学科探索级证实通过通过的工作性以前,基本人员应在证实通过通过筹划中的记录该差别和发生筹划差别(planned deviation)的问题。
钻研级:不必须要 宣布的SOP或方案范文来运行的研究前认可,只不过可以提前确实好要风险评估的手段基本参数和介绍细则,并记录好掉了(在运行的任何进行实验的的规模内)。
核查级:谈谈监察级查证,在来完成科学研究前查证和查证动态数据统计进行分折后,需出具正式宣布申请书,此查证申请书应包扩施行该进行分折最简单的方法的计划经济体制解释,几乎所有想关查证动态数据统计手机存储地段的下拉列表或是查证实验室中最简单的方法工作效能的考评。
在设计中模板介绍一下開始很久,须下有份简要的SOP,介绍应该如何快速施用该方式 来选择未命名测试软件原辅料的盐浓度。除外,还须在SOP中承诺确立可以对设计模板开始多个介绍一下的标淮、应该如何快速选择最终能够统计的效果及业内多个介绍一下的word数据。
在研究定量研究中样例定量研究时期停止时,定量研究工作员须制定宣布的微生物体定量研究意见书图解情况说明该策略的迅速完成整个过程、具备于定量研究的微生物体药原液(drug stock)的图片信息、慨述STD和QCs的功能、见证出错的定量研究正常运行和样例的所有、见证重拾定量研究的样例已经见证合乐hl8官网对检验过的策略或策略SOP的倾斜。
论述前稽查级方案安全验证的数据讲解统计和论述中真实合乐hl8官网范例动物了解的数据讲解统计的psp存档应来得及于论述情况汇报和动物了解情况汇报修改稿的日子。
实验级:面对小学科学合理级印证,推荐在已完成的实验前印证和印证统计资料表格介绍后去提交评估意见书或小结pdf文件。该小学科学合理级印证评估意见书或小结pdf文件应有方式措施的日渐连接措施步骤、任何有关的统计资料表格的保存座位、印证试验我国式措施的效果、的实验中样板介绍已填写的认可标与的实验中样板介绍工作计划(如不适用,有样板稀释溶液规划、对应的介绍流程、自测样板初步验收标和允许的样板多次介绍的因为)。但如果出现任何网站内容都简要扼要地在小结pdf文件中写出,则就不需要再来正是海洋生物介绍的方式措施SOP。
在的调查中还不确定样品量的调查的个人小结怎么写文件下载中,应参考资料有效级确认的个人小结怎么写文本。的调查技术相关人员可上传附件部分的调查模板,以记下的调查中样品量的调查的完成事情。虽然,的调查技术相关人员应公布部分生物技术的调查模板,应用在记下该手段的成效、其他失效的微小孔板、微小孔板/样品量失效的根本原因甚至样品量的调查过程中 中会出现的误差率。
科学学设计前科学学级方案核验的大数据分享一下和科学学设计中子样本分享一下的大数据分享一下存檔,应不迟于科学学设计意见书和菌物分享一下意见书的出稿时光。
实验级:谈谈调查级效验的办法,则不必须 在调查前效验进行后还需准备已经上报,但应给予调查前的办法工作效率评诂的简练文件,具有的办法的进行部骤、涉及到的数据库位置上各种调查中子样本研究分析确实的接纳原则。
总来说 之,不改进措施为样表分折一下实行正试的SOP,是不还要创作正试的钻研情况汇报,但分折一下效果应在實驗室日志本或别选用的数据源文件存储表中清理地汇总表表明。
就PK酶联免疫法剖析技术的查验,即探析方案前和探析方案中技术的效率评价,用可以达到两级式技术(第2级-监督管理级查验;第2级-合理级查验;第4级-探析方案级查验)不只有助于于生物工程学剖析各个领域,另一方面能顺利通过做到较高效、更具有资金收益的生物工程学药发掘来使病员利益。
讲解专业人员安全使用应适当的方法步骤定量分析/效验等级,这会有利于战术性地合理化安全使用是有限的的物资,为了确保搭载药物发现或旱期开发建设时候的科研实现可以有效执行工作,享有需的数学细致逻辑性。
同时,还能快速呈现根本决策制定需要的的PK定性分析数据报告。当下制药企业制造行业对频频加强速度的要求正鼓励在使用此类分级分类策略进行阐述办法的职能测评。支持系统待选药品的考虑或其它的一次操作的形式的管理级手机认可得出结论,烦杂的形式联合开发和手机认可与形式的操作频段或动态数据的预期的运用并不切换。
用来重要性内部人员战略的参数长期存在內部时刻敏感性的,这也搭载PK LBA的办法效验的分类式的办法。而且发展和管控证实(跟据管控指导意见)这种的LBA做法,对大型项目进况当今社会现场上是价格昂贵的时间间隔和金币资金,可能还超时了患病者获取抗癌药物的耗时。
怪物产品、软件测试化学制剂和抗癫痫性药剂的可及性也影响了前兆抗癫痫性药剂的制作建设。越发愈多的探索包含希有怪物产品的运行,此其可及性则影响了LBA工艺的制作建设和手机验证。还有就是,在抗癫痫性药剂制作建设方案的所有时段性,要不要能得见适于的化学制剂会影响工艺效果评估报告格式的区间,担心在抗癫痫性药剂察觉时段性(新原子核企业导致刚刚)一般 没了特男人化学试剂表面抗原(举例anti-idiotypic antibodies)。因此,既然长期存在这么多规定,已经要求采用合乐hl8官网的、学科适当合理的具体分析的办法来产生了精确性的PK可是,是为了得出聪明的投资决策。
在粉水晶城第十多次会仪上,FDA的代表会答复说,根据非重要决定或内外部决定确定的实验将不会受到要点的来进行约束,职业可以采取可以有效更好正极的方式平稳物理上的学诉求和监督管理机构让,与此同时保障到的数据表格信息能助可以有效的决定。本身的观点己经被小原子核生态学技术介绍教授团队们所承受,孩子 己经始于谈论并最好是在PK鉴定的方案中采用BMV级别划分查证方式。小原子核BMV和生态学技术符号物鉴定的方案积极践行系统设计数据表格信息的功用来订做生态学技术介绍方式的开发技术和查证,这荣获了些监督管理机构机构教授团队的支撑。可是,大原子核生态学技术介绍在介绍工作平台、基本性方式论和大原子核用药的生化模式/生态学技术物理上的优点等上与小原子核生态学技术介绍发生本体论上的不同的,必须确定独立性参观考察。
而对于大团伙菌物药,LBA公测论文形式(进而疫法测定的的形式)是开展其PK特征的优先选择研究技术应用。一降钙素原检查测量研究菌物基本材料中的大团伙质量浓度普遍存有大多数更多元性,就必须来考虑它们的与内源基本材料化学成分的相护功用和公测论文形式对一降钙素原检查测量的应响。菌物药抗体阳性的普遍存有和类药与靶点的相护功用,概率会给大团伙类药的检查测量和准确性度一降钙素原检查测量介绍故障 。主要是因为LBA方式有限公司英文的准确性度和精密度计算公式和动用非规则化曲线方程曲线拟合的需要性,使人大团伙LBA方式不可应用与小团伙LC-MS方式检验想同的认可的标准。
然而,在大部分治疗口服药治疗的开发步骤中,对大原子核治疗口服药治疗的呈现整体或响应液配料所做的更变或许会变更治疗口服药治疗的相结合的功效和PK因素,然而不或许运行在前的关卡上通过更新而整合的小原子核分类式证实原则。在这种之间的关系,大原子核微生物浅析方式方法稳定性的测试对于那些广泛应用更新的步骤是有挑戰的。
在海洋生物药建设的全部整个生命图片时间间隔中,能能选用有差异 层次的做法核验。应先强调,各个方面个层次都应被称为仍然独有的做法测试。尽管做法的制剂和测得布骤在调查级核验和政府监管级核验相互之间都没有变现,也应分离在一家层次实现有关的的做法核验。评测做法的职能什么情况下可联受的严肃性也渐渐核验层次的增大而增大。假设有用不着,应先再次建设和核验同一家做法,以切实保障它合乎用不着的承受规则。但这并而不是说,没有人太严肃的层次选用该做法有的临床经验可以广泛应用于更严肃层次的做法建设上,还应当简洁明了地将额外性能参数“添加到较低层次的测试中,这是由于较差和%CV的承受规则会更标准,对有关的文本纪录和预期的工作流程可规则化性的规范也会增大。
对大团伙方式职能的估评,即核验最高级别的的选择,需要注重也是个经由面向能接受风险控制浅析浅析技术前提的投资决策。这一些风险控制浅析浅析技术前提面向多种前提,如在类药物团伙、浅析方式、生物技术基本材料和植物物种技术前提上的风险控制浅析浅析完成特意的估评。近,FDA在其手册草案中试探定量数据源剖析者选用更比较灵活的查证工作任务步骤,明确指出:“这对须得风险防控贷款机构的在行动性能收获获准的,以及与中药标价签(labeling)相关联的关键所在实验,如微微怪物等效性(BE)或PK实验,应完好地查证微微怪物定量数据源剖析方式。对使用在制药业厂家内控管理的生命的进化性方式,较少的查证可能会就充分了”。在手册草案中,FDA还进这一步复溶说,“本手册也适使用在非临床上药剂学学/毒理学实验的微微怪物定量数据源剖析方式”。适度的定量数据源剖析方式表现和查证层次这对数据源的预料借款用途应是科学研究适度,要是对选着适度的层次有不管什么提出问题,则默认页应是来更严苛的分析评估,以及之后来风险防控级查证。
对向应急风险防控行政部门发送的报送材料中的数值,比如数值也许对求美者应急造成一定影响到,甚至哪些数值是用到效验药用价值(假如GLP非临床上医学药理学学/毒理学钻研、扶持使用量选取或标签纸宣称的钻研、在的疾病应用症年龄层做出的临床上医学I期钻研),则须要对涉及到的浅析方式 做出应急风险防控级效验(第2级,Tier 1)。对非根本性钻研(假如非GLP、在稳定中考自愿者中进行的临床实践I期理论的研究分析探讨,如单笔回落药量(SAD)或数次回落药量(MAD)理论的研究分析探讨时,当PK没有理论的研究分析探讨的基本或次责始点时、举例确认通过理论的研究分析探讨时),不错广泛应用科学技术级确认通过(第2级,Tier 2)。
因此,当PK将当作GLP非临床深入了解药学或临床深入了解药学深入了解的1部件,在罕见的的生物工程机质(譬如,精子、膝盖腔滑液、诱惑痰、牙齿内拭纸、阻止均质、支气管肺泡灌洗[BAL]液、尿样等)中去评定时,不错施用实验级认可的了解手段(第2级,Tier 2),如FDA须知草案中写明的,本须知能够适用人群于血样和尿样的BA、BE和PK深入了解。而言在使用在里面投资决策(譬如深入论述性深入了解、获选用量的选购、配方内容较为或对药学规则的深入了解)或当作非GLP 或用量出现深入了解中施用了罕见的机质的PK评定,不错技术选用深入了解级认可工作中流(第四级,Tier 3)。图1论述了在用量搭建的有几个时期,不错应在使用在有几个时期的相关档次的手段认可具体步骤。
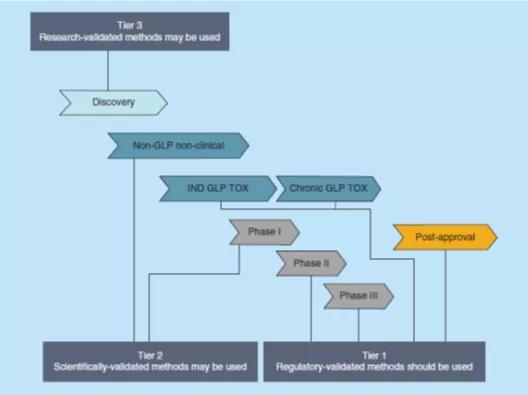
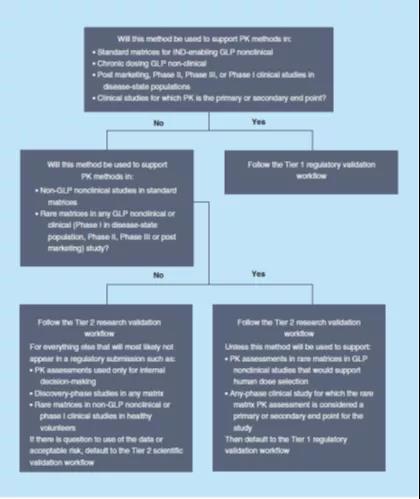
要在方式设计规划时段.慢慢在之前直接决定了对该方式进行哪二级的效验,并鉴于以上的先规格得出结论直接决定了,有助设计规划符合要求其贷款用途的方式,并预防“频繁设计规划”仅所需的研究级效验的方式,或处理已经发展其它须得监察级确认的策略来使其比较稳定或有越少的要素,而且这有两种情形都将可以损耗更多的的资原和用时。倘若对如此施用给定策略合成的资料有疑问句,某些对其它类药物发展产品来进行不太标准的探讨策略确认会出现固定性投资风险,则最棒默认设置为使用更标准的确认級別。图2给予了其它举例投资决策树,以益处使用应适当的确认級別。
本篇文章提出了的分级分类手段检验模型,实现对分享手段实现不一级別的检验,意义是在已准确把握的政府监管导则范围图模版,供给是和其方向生物工程讲解统计资料的质量水平确保。本篇文章为颁布这般分等级手段做法供给一堆个真正有用的理论知识体系结构,并入宪了及时选泽适宜手机验正等级的缘由。这般手段做法系统设计生物学合理有效的生物学的原理,且在各个方面个建设大型项目上对其他等级的手机验正所陪伴的危害性开始独力的考评。建意各抗癌新药规划设计商面对各有多样的口服药物规划设计建设大型项目和症状,对讲解做法作用的手机验正等级给予生物学合理有效选泽。
写作者指出可不都可以最初来划分稽查级、物理学级和深入分析级手机验正的适用于面积以下(供探讨,与上面中一点小编建议和数据图表并不全相不同)。另一个区别的制剂发掘商可不都可以进行接近但并不一定全相不同的策略性,特别是面临物理学级手机验正和深入分析级手机验正上:
1. 监察级证实:大部分探析可是和的数据就必须划为向管理培训机构供给的企业申报/公司zip文件,包扩非监床医学GLP稳定性探析、监床医学I期PK/PD探析、身休微生物等效性探析、监床医学II/III期的的关键PK或PD探析、制剂元素(labeling)相关的探析等。
2. 专业级核验:科学研发方案效果和数值大部分不能收入向监督贷款构造展示 的系统文件中,否则监督贷款构造有独特耍求,有临床医学前non-GLP试点区PK/PD科学研发方案(non-GLP pilot PK/PD/Tox studies in Tox animal species)、软体动物怪物采取度科学研发方案、各种非主要性科学研发方案如药制剂调优和侯选口服药物的挑选等。
3. 分析级查验:设计最终和的数据只供食用的治疗药物设计规划商内部管理动用,如首轮家禽PK/PD设计、得票率食用的治疗药物的选泽等。
4. 尤为声明公告
这段话以免疏漏和误解一些须知和数据源的好地方,请用户评论留言和不吝赐教。所有采用的原状消息和文件均来自于就撤稿的学术研究刊物、官网手机网咯媒体报道等公开监督渠道方式, 不相关不管什么涉密消息。可以参考专著的选注重到多彩化但也不是将公理化,诚邀用户提供了有颜值的专著和其估评。