上周,“袁来如此”专栏正式开篇,合乐hl8官网医药子公司深圳博瑞副总经理袁智博士以《大分子生物分析概论(一):大分子药物生物分析的基础知识》为题,梳理了大分子药物分析方法的基础概念。
本月进行,“袁来一样”栏目勉强LBA定量分析的方式的风险管控验合乐hl8官网过选取具体介绍书,预计在将有好几篇新一轮干活知识信息展现,拨冗莅临垂注!
1992年,意大利弗吉尼亚州绿水晶城,世界上首例关与微生物剖析办法证实会议触屏主持召开,电视电话办公会议计划方案有目共睹的怪物回收利用度、怪物等效性和药代的动测力理论研究的怪物阐述技巧形成了就这样药业服务行业去怪物阐述技巧查证的实际情况行为准则。史称珍珠城电视电话办公会议。
宝石城电视电话会议安排通知还研讨稿了怪物研究技巧步骤查证的广泛相关问题,与此同时也说了色谱和非色谱试验技巧步骤(还包括免疫细胞试验技巧步骤和微怪物技巧步骤)彼此存有差异化。以宝石城电视电话会议安排通知为依据,售后的产业电视电话会议安排通知和论文资料对怪物研究技巧步骤查证完成了频繁研讨稿。
迄今直到直到,大众偏重视的是标准小碳原子制剂的生物制品概述做法的检验,其主要理由是自打一九九零年后,作为一个小碳原子类药的正规讲解工貝——并联电路图式色谱仪色谱-质谱仪(LC-MS/MS)的安全使用效率在迅速地上涨。而大团伙的海洋生物介绍方案亦为此效仿颇多。
在今天中,LBA 是免疫细胞测试图片具体最简单的方法(immunoassays)的同义词,指其余立于大团伙相互之间的作用来进行定量具体分析具体分析的具体最简单的方法;稽查确认(regulatory validation)则是在查证前方法生产生的讲解动态数据,可供生态学用量的临床药理护理前毒理学习和临床药理护理审报、注册公司使用的。后面短文将简略解说稽查查证或非稽查查证左右的一定的差异,为谢的关注。
其中一个具体分析的方式的生命力周期性大多数可划分成3个时间段:的方式定制开发(method development)、的研究前校验(pre-study validation)和了解中证实(in-study validation)。手段激发是成立了解手段的流程,而了解前证实是对了解手段确实认,了解中证实则是在软件流程中,如出显重要的成分突发变迁后,做的方面证实。
要想保障两个了解的办法要用于脂溶性式酶联免疫法,以大力支持药代动能学具体进行分析,并经得住监督检查核审,必须要 对某个了解的办法的不同的组建那部分确定具体进行分析、证实和一直监控录像。因而,但凡选用该了解的办法,其证实可以说是两个一直的时候。
于是,技术核实是一种个动态信息的环节。表1汇总了了必须评估报告格式的多组分和对阐述技术生物期限中每一位关键期的提倡。今天的策划 也相当于于那些工艺多组分,在相对应的的节章中,将研讨会在差异步骤中可能性开发的活動的更完整版、详信的短信。
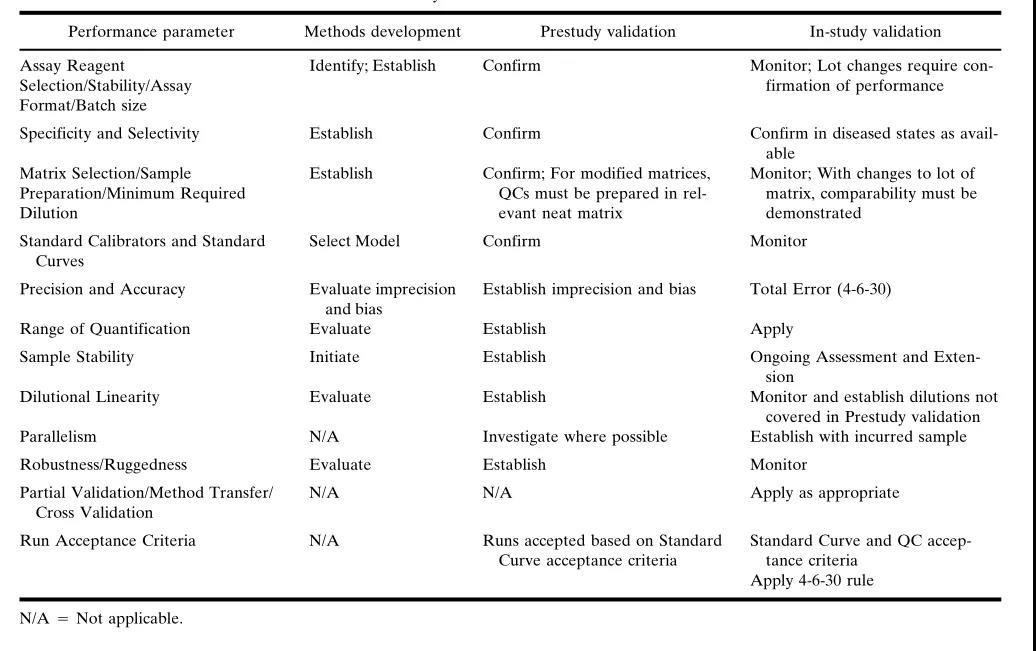
的方法開發时候
在做法开放方式中提取的新问题应记录查询在进行实验性室种草电脑笔记本或其余可配受的pdf文件主要形式中。应收录下列测量新问题:关键性探测免疫进行实验试剂的选定和增强性、测量格局的选定(表面抗原、溶解稀释液、微小孔板、探测设备等)、标准规定折线实体模型的选定、范例机质的选定、免疫进行实验试剂的特女性朋友、范例光催化原理、第一次的增强性探讨方案和做法稳进性(robustness)的第一次测量。在做法开放分阶段结束了之时,应提取做法草案或做法校验运行索引(即要使用的进行实验性),供探讨方案前校验哺乳期间参考使用。
研发前手机验证阶段中,
在开端科研前核验的科学试验室已经,应写作有很大个的办法核验预计也应该是应该基准恰当的的标准实际操作系统 (SOP),以狠抓科研前核验需提交要做的科学试验室有有很大个予以提纲。此核验预计应该是有很大个独立自主的word表格,也应该是科学试验室室记载本或像word表格的有有些。该文件下载应分为对这个策略预期结果领域的描素已经必须要手机验证的耐腐蚀性运作,此类运作分为但不包括但不限于的准则拟合曲线、精比热容和精准的性、一定量依据、特异形和选定义、安全稳定义、调制非线性、稳定性、操作强弱(批号batch/run size)和操作做的准则。该查证事业计划应包含拟完成的科研事业所科研的每隔耐热性因素的对象确认原则。成功完成校验试验后,应书写每份进一步的评估,评估的后缀名也可以由试验室的内部结构政策解读绝对,此评估应统计报表测试英文稳定性数据库、牵涉到方式 SOP或校验工作规划的偏差值或者很多想关想关新信息。科研中效验时段.
在实践时中,探析人群需制成一般包括相应测算参数指标的细则身材曲线和产品质量设定样机(QC)的积累统计数据统计报表表,并将其与探析模板的分析指数值统计报表到从而的探析通知单中。与探析前查验的不同的是,这么多电子表格中不包扩失利的运动。从而报告格式中需涉及到的其它企业信息包扩:具体分析历程中发生的的误差率剖析、重覆剖析的样本量盘点及的原因各类因此未凭借电脑运行的完整讯息的盘点表。4.测试试剂的选择、稳定性、测试格式和运行/批次大小(batch/run size)LBA深入分析形式的重要组合而成部份是配体化学生化化学制剂(ligand reagent),基本上是用来免疫抗体性各种測試的同一个或成对抗原。于此,许多配体化学生化化学制剂还将会包扩联系蛋白酶(binding protein)、多巴胺受体(receptor)、寡核苷酸(oligonucleotide)和多肽电影片段。为比较简单尽量,本段仅谈话免疫抗体性各种測試用的化学生化化学制剂(必要抉择有有效炎症因子朋友和抉择性化学生化化学制剂,其不得含有会经久耐用且保持稳定地组成抗原/抗原软型物的联系基本特征)。LBA的各种测试文件后缀涉及但不只限:夹心式、竞争力式、一直或间接性结合在一起可以抑制甚至固相或液体相的软件测试制式。一名非常典型的测量开机运行(batch/run)蕴含了标准的标定原辅料(standard calibrator)、查证原辅料(validation sample)、QC 合格品和深入分析模板(study sample),在app要查验的手段时要将这些看做整个开展解析。在很好概况下,要求最底个数的QC试品应主要给定启动中探讨样板数量的5%。就通过纳米纤维板的考试方案,个启动应该主要包括多家孤立的纳米纤维板,但各个纳米纤维板应一般包括孤立的几组进行校正试品和QC试品。
的办法发掘时间段
步骤搭建的一个步骤是选定 检验后缀名。对待固相检验,需选定 一定抗体阳性或其他的核苷酸质。如肾上腺素受体的固相,常以氟塑料和窗玻璃外壁,但两种钢材相互间的的差异可能会太大,还要干扰步骤的灵敏性度和进化性。如果你取舍主动权吸(active adsorption,举例avidin-biotin),则需选定 主要用于发生变化固相外壁(包板)的适合的的物理反应迟钝。压制吸(passive adsorption)是最喜欢用的包板步骤,但会接受所取舍的缓存液特点(举例盐氢氧化钠溶液密度和pH)的干扰,需十分地选定 包板氢氧化钠溶液的氢氧化钠溶液密度/大小、混合物核苷酸质的模试(晃荡与涡流)和包板的气温。在选择测试稀释液时,必须考虑待测物、预期的基质和结合实体(例如抗体或受体)的具体特征。例如,可能需要添加重金属或螯合剂,以便确认达到最佳的结合状态。此外,还可能需要考虑去污剂(例如,Tween-20或Triton-X100)或填充蛋白(如albumin,casein或gelatin),从而优化测试方法的性能。
进行实验方式中需要挑选适合自己的数据信息测量设备,以提供数据可配受的数据信息并使蓝本噪音污染最长化。操作比色法(colorimetry)在内的数据信息测量设备,还可以从而提高测量的快速度。这种测量数据信息设备有荧光、物理普通机械发亮、牵扯性检测和电物理普通机械发亮。使用信号放大系统可以实现更高的灵敏度。除了分析方法的各个组分外,在方法开发过程中,还应当选择、建立和运行该分析方法的格式,如竞争式或非竞争式。
应当建立分析配置(assay configuration,例如标准品、QC样品和研究样本在微孔板上的位置),并测试与预期的研究中测试运行相同数量的微孔板。应当根据测试方法的性能与所需的测试精密度之间的关系来确定用于标准品、QC样品和研究样本的重复孔数量。虽然最终结果可以基于单孔或复孔的分析结果,但确定QC样品结果的重复孔数量必须与用于获取真实样本结果的重复孔数量相同。
对行驶内(intra-batch/run)和行驶间(inter-batch/run)测式能力的考核,须得为4个校验子模板生成二维码多条然而,中间4个然而全部都是选择相似孔的出现异常值算的。测式行驶的数目和4个子模板的相似孔然而(即相似检测的然而)的数目应足够的大,而使安全合乐hl8官网地基本上该测式技术的能力有特点。稍后在关干既定能力有特点(举例,精密度计算公式和更准性)的方面中,将提供 关干最长测式行驶/相似孔数目的最好是。
科学研究前查验过程
在最简单的的办法核实时,应由使用的在最简单的的办法开发技术工作辨别的和整合了的重要的所在测式免疫实验化学试剂(代称重要的所在免疫实验化学试剂),且不可能改动,并在最简单的的办法SOP中酌情logo。在最简单的的办法核实的工作中,将验证最简单的的办法草案中界定的这个重要的所在免疫实验化学试剂的效能。还应由验证介绍配置单(如细孔板需求量、标准单位品和验正检样的位子、连续孔次数、进行必要条件等)与在最简单的方法建设时候中确保的考试程序运行的大大小小(batch/run size)。钻研中手机验证阶段中,
在测试英文策略的人身安全周期长中,一般 要求调整另一个关键因素因素成分(假如化学药品批)。对已效验成分的调整,要求确定局部效验,来单位证明其兼具有些相似的特点。显然,还可能操作在常见了解正常运作中QC合格品存在的可连受没想到,来减少关键因素因素化学药品(不分为考生标淮,reference standard)的更有效期,和须得要根据这个统计数据,细细收录有郊期的廷长。在研究分析中安全验证时,需要使用过后查证过的检验方法论文格式文件,此事论文格式文件的所有变更均应清晰可见地信息在案。如果参与了非常大变更,则也许须得参与要素查证,以验证检验方法稳定性的对比性。5.参照(比)物(REFERENCE MATERIAL)在制作规范标准复位品(standard calibrator)、核实土样和QC土样的的原材料清单因素会出现所不一。须主要熟悉的原材料清单的因素及相关联表示的原材料。在的条件能的具体现状下,尽或许地将规定规范品、核验供试品、QC供试品等从同时源原材料的直接灌装(separate aliquot)小份中配制。操作(比)物在制造比较有限公司的具体现状下(随后,用药主动功效研究方案,在这其中纯规定规范品会从商务区化学制剂盒这些的比较有限公司源领取),也可以用出示不一样生产批号或某些商务区商品价格之間的对比性后,从同时个单独某个等分(single aliquot)原材料中配制规定规范品和QC供试品。6.特异性(specificity)和选择性(selectivity)抗体的特异性(specificity)是指其结合目标抗原的能力。在理想的情况下,所使用的抗体对待测物是特异性的,即不与样品中可能存在的待测物的变异体,或其他结构相关的物质发生交叉反应。特异性有时与交叉反应性的概念有关,如果抗体是高度特异性的,则其交叉反应性较低。
使用性(selectivity)都是个与炎症因子聊天关干的慨念,都是种剖析手段在模本中现实存在某个营养成分表的条件下查测待测物的特性。常见,LBA不用办理样机预整理(举个例子浸出),可会直接在生物工程产品中测定法待测物的氧化还原电位,但此制作具体方法或将遭到制剂与模本产品营养成分表的交叠不起作用所因起的非炎症因子聊天不起作用的作用。炎症因子聊天和使用性考核将检验该剖析手段是不是理解测物存在炎症因子聊天,还有就是就能够从冗杂的产品中使用性地酶联免疫法待测物,而不被顺向或负向的干拢所作用。
方式制作价段
介绍措施的非特异朋友将衡量于所用的抗原或抗原对(antibody pair)的及时敲定的非特异朋友。抗原可能从商业性來源荣获或内控制造。无论是否那类现象,在选泽在之前都须得评价指标抗原相结合因素的数据信息,评估报告剖析非特异聊天的的方法基本是剖析范本基本材料,试品基本材料+与众不同浓硫酸浓度的待测物举例突变体、生物学普通机械上一样的有机氧化物以其试品基本材料+可能性与待测物按份共有运行的有机氧化物。
在某些情况下,可以使用一个样本基质来评估特异性,该样本基质包含与体内浓度相当的一种或多种与待测物有关的化合物。通常,竞争式测试图片图片格式比夹心式测试格式更易受干扰物的干扰,因为夹心式分析方法使用两种抗体,故具有更大的特异性。
如果无法获得待测物的变异体或相关形式,则可能无法在方法开发过程中生成交叉反应性(分析特异性assay specificity)数据。因此,可能需要对经过验证的分析方法的特异性进行回顾性评估,因为随着时间的流逝,将产生更多有关待测物行为的数据。
在具体方式方法开发设计全过程中,考核报告格式的保护性是考核报告格式有基本材料营养化学成分时对测物的酶联免疫法。一些基本材料营养化学成分很有机会会骚扰免疫抗体与待测物的组合,还应在酶联免疫法至少值(LLOQ,即至少低级别QC样机的氨水密度)或之端的符近外接待测物到同一条子样本基本材料类行的二个批次线(最好不要10个)中,并考核报告格式相对于不确实度的百分比例(%RE)。尽量的保护性问題常在酶联免疫法领域的同价位发生,也要有在较高待测物氨水密度下考核报告格式的保护性。在环境骚扰与氨水密度关于 的问题下,必须要确实在那家待测物的氨水密度一样很有机会突然出现骚扰。在具体方式方法效验先前,很有机会要有合理地提高至少的酶联免疫法限。
研究分析前查证一阶段
研究方案前的查验的时候将查证浅析措施的特情人和食用性机械性能(食用最相关内容的类化合物和模本栽培基本材料)。食用性由再利用率(recovery)是,再利用率的接纳的规范与正确性评估报告同。推见的食用性接纳的规范是:必须80%被选为估报告的模本栽培基本材料均荣获可配纳的再利用率。理论研究中查证第一阶段
在范例研究期间中,一般而言不具有根据特女性朋友和敲定性的进行标准化。假设具有内在的的扰乱疑问,则必要之前敲定范例的效合乐hl8官网点,并做相同的解决。一般而言现象下,症状情况的范例栽培栽培基质可能性包含了较栽培栽培基质中不具有的组分,举例,类风湿病成分(rheumatoid factor)掉下来的可可溶感觉,出于自我免疫力性问题的异源电磁波辐射、高血糖(lipemic)样品、溶血(hemolyzed)样品等。故此,浓烈小编建议在可以获得相应问题状况的样品产品后,再次做出取舍性和特男人研究。拆卸抵抗能力院校代号后,也要从新安全验证特男人和取舍性。这段话知悉疏漏和片面性相关内容导则和的数据的场所,请萌芽杂志回帖和斧正。所有调用的最原始的信息内容和材料均原于以及刊发学界中文核心期刊、非官方网咯简报等公开透明途径, 不涵盖任何人保秘的信息内容。满足论文资料的选用满足到齐全化但就说可能性健全,欢迎大家萌芽杂志能提供有总价值的论文资料以及其测评。
8. 优化了解
袁来如此|大分子生物分析概论(一):大分子药物生物分析的基础知识
1. V. P. Shah, et al. Analytical methods validation: bioavailability, bioequivalence, and pharmacokinetic studies. Pharm. Res. 9:588–592 (1992).2. J. W. A. Findlay, et al. Validation of Immunoassays for bioanalysis: A pharmaceutical industry perspective. J. Pharm. Biomed. Anal. 21:1249–1273 (2000).3. C. M. Riley and T. W. Rosanke. Development of validation of analytical methods: progress in pharmaceutical and biomedical analysis (vol 3) Elsevier (Pergamon), NY 1996.
4. V. P. Shah, K et al. Analytical methods validation: bioavailability, bioequivalence and pharmacokinetics studies. Conference Report. Eur J Drug Metabol Pharmacokinetics 16:249–255 (1991).
5. Guideline on validation of analytical procedures: definitions and terminology International Conference of Harmonization (ICH) of Technical Requirements for the Registration of Pharmaceuticals for Human Use Geneva 1995 (1996).
6. V. P. Shah, et al. Bioanalytical method validation. A revisit with a decade of progress. Pharm. Res. 17:1551–1557 (2000).
7. K. J. Miller, et al. Workshop on Bioanalytical Methods Validation for Macromolecules: Summary Report. Pharm. Res. 18:1373–1383 (2001).
8. Guidance for the Industry. Bioanalytical Method Validation US Department of Health and Human Services FDA (CDER) and (CVM) May 2001.
9. DeSilva B, et al. Recommendations for the bioanalytical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules. Pharm Res. 2003;20:1885–900.
10. J. O. Westgard. Points of care in using statistics in method comparison studies. Clin. Chem. 44:2240–2242 (1998).
11. Watson, RG, et al. Implementing a tiered approach to bioanalytical method validation for large molecule ligand-binding assay methods in pharmacokinetic assessments. Bioanalysis. 2017 9(18):1407-1422
12. D. Rodbard, et al. Kinetics of Two-Site Immunoradiometric (Sandwich) Assays-II. Immunochem. 15:77–82 (1978).
13. B. D. Plikaytis, et al. Determination of parallelism and nonparallelism in bioassay dilution curves. J. Clin. Microbiol. 32: 2441–2447 (1994).
14. C. Hartmann, et al. Reappraisal of hypothesis testing for method validation; Detection of systematic error by comparing the means of two methods or two laboratories. Analytical Chem. 67:4491–4499 (1995).
15. S. R. Searle, et al. Variance Components Chapter 3. John Wiley & Sons, Inc, New York, NY (1992).
16. R. W. Mee. b-expectation and b-content tolerance limits for balanced one-way ANOVA random model. Technometrics 26:251–254 (1984).


























