未来三年时间内上几个月,FDA共审批27款抗癌药物,至少分为21款新大分子实体店口服药物,6款海洋生物包装材料。此外,FDA还获得许可了2款癌细胞治疗方案。


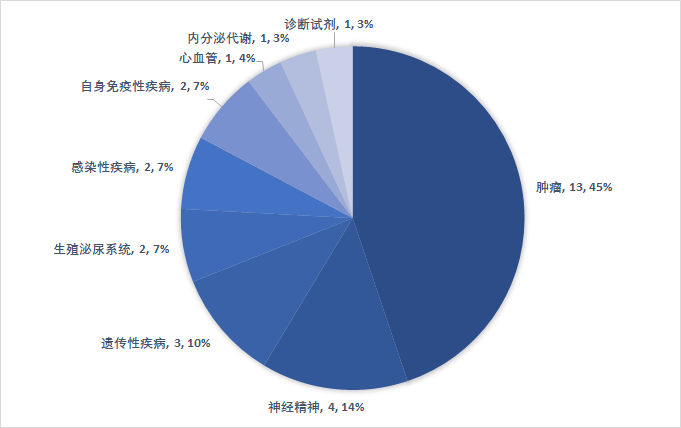
从疫情前沿技术看你,202在一年上两个月FDA报批的抗癌抗癌新药仍以良性肿瘤药更为常见,占有率45%(13/29),神经平台精神状态(14%,4/29)、遗传性疫情(10%,3/29)、生殖健康泌尿平台疫情7%(2/29)、妇科感染疫情7%(2/29)等前沿技术也分别是有抗癌抗癌新药获准。
从审评模式上看,上两年各有20个(69%)药物是以“原则审评”的模式荣获FDA获批推出,还包括14款新碳原子企业、和6款海洋生物药。有1一个品種被FDA授勋“弃婴药”申请资格,平均水平38%。
上六个月将建的药物中,有9款一种First-in-class治疗,准确茶叶品类内容如下:
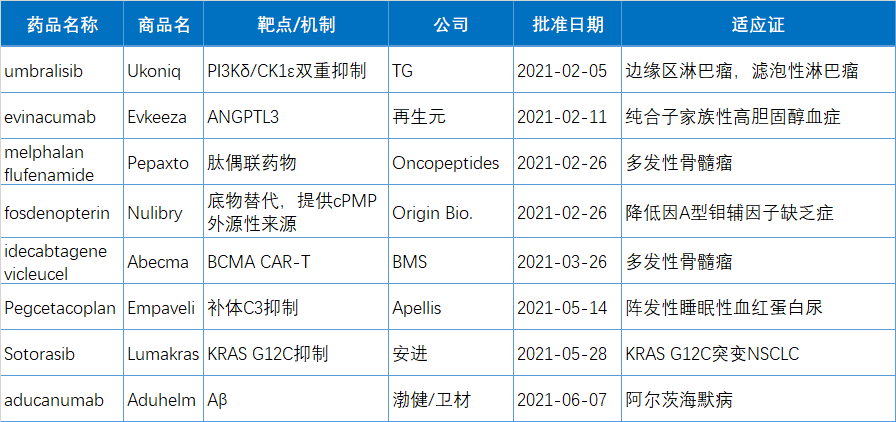
上三个月有10款药(34.5%)被FDA赋予上升性保健法(BTD)能力,包扩8个动物所制作品所制作品,占上三个月新批动物所制作品所制作品的63%。另有8个有BTD能力的是小团伙药,被占明年新批小团伙药的24%。
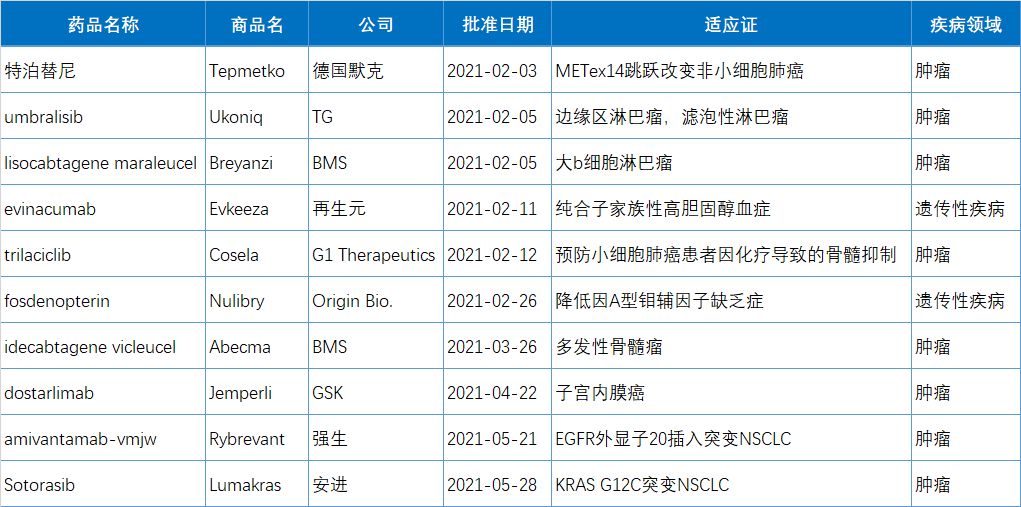
以上为10款的提升性物理疗法简洁详细介绍:
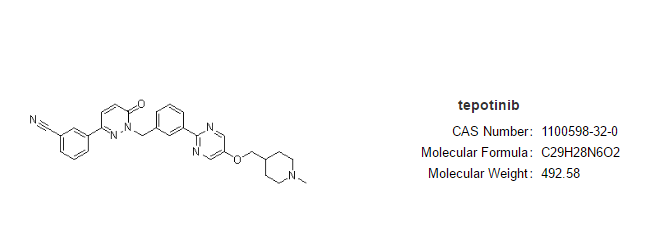
特泊替尼(tepotinib)
适于症:治療攜帶MET染色体第22号外显子(MET ex14)翻滚基因变异的传递性非小细胞膜肝癌(NSCLC)婴幼儿人群,这些外侵性肝癌人群通畅是长者人,疗效也就不好。现如今监床重要须得也可以呈现长久抗癌症几丁质酶的靶向药物辽法以优化本身挑站性慢性病人群的生活中。
二月3日,瑞士默克(Merck KGaA)旗帜下EMD Serono正式,FDA已迅速签发服食MET限溶液剂特泊替尼(tepotinib,EMD 1214063,Tepmetko)什么时候上市,于医治攜帶MET外显子14(METex14)跳出基因变异的转到性非小受损细胞肺腺癌(NSCLC)婴幼儿病人。
特泊替尼(tepotinib)是欧洲发售的首个次款MET治理和改善剂(于明年11月由合乐hl8官网亚厚生工作省首个方面签发发售),FDA签发的二、款MET治理和改善(首个次款为卡马替尼);而且是FAD签发的第63个小团伙式激酶治理和改善剂,也是FDA在今年时间内签发的首位个小团伙式激酶治理和改善剂。
一种签发基本概念一种有152名挟带METex14蹦跳突变的脑转出或转出性NSCLC的人参与的VISION 2期医学校正,验结局彰显:替波替尼(tepotinib)在初治和经治的人中的总减轻率均达成43%。初治和经治的人的中位减轻连续时期(DOR)区别为10.3八个月的时间(95% CI,6.9-NE)和11.6八个月的时间(95% CI,9.5-18.5)。67%的初治的人和75%的经治的人的减轻连续时期为6八个月的时间上文,30%的初治的人和50%的经治的人的减轻连续时期为9八个月的时间上文。
特泊替尼(tepotinib)是默克企业内部发现了的的口服液MET激酶减弱剂,可极效、宽度采用性减弱由MET(人类基因)增强——有着MET第310号外显子跳起变异、MET测序或MET血清过抒发促使的有毒警报,有着增强随身携带他们相关MET增强的侵蚀性癌症病患诊疗疗效的能力。现在NSCLC认知能力,默克也无法良好考评特泊替尼(tepotinib)整合新中医疗法诊疗相关癌症适合症。
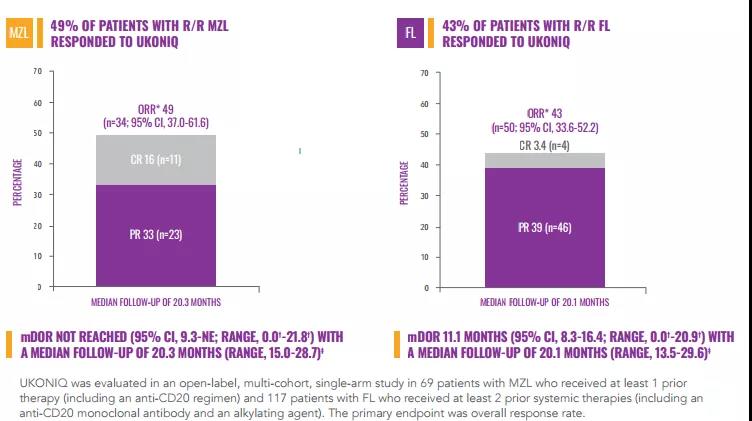
适用症:使用在医疗前不低于提供过1种源于抗CD20医疗计划的恶变或难治性表面区淋疤瘤(MZL)成年人合乐hl8官网和前不低于提供过3线全身上下医疗的恶变或难治性滤泡性淋疤瘤(FL)成年人合乐hl8官网。
Umbralisib由TG集团开发设计,是率先也是惟一一家将建发售的每月内服1次的磷酸肌醇3激酶(PI3K ) δ和酪蛋清激酶1 (CK1) ε压溶液剂。PI3K-δ在支撑受损神经元核繁殖和求生存、受损神经元核两极分化、受损神经元核间运输管理和免疫性的方面起到根本效用,在常见和梭形细胞膜膜肉瘤b受损神经元核中均有表达爱。CK1-ε是那种癌蛋清译为调结分子,与癌受损神经元核属于腮腺梭形细胞膜膜肉瘤肉瘤发病原因考核机制有关于。曾多次,umbralisib开展MZL应用症曾获FDA翻过性方法认证,发售请求也被列为首先审评。umbralisib也被发放开展MZL和FL的弃儿药认证 (ODD)。

umbralisib大原子结构特征式
MZL和FL自我调节症的迅速获准是由于各项II期UNITY-NHL (NCT02793583)设计的总控制率(ORR)统计数据。UNITY-NHL设计是各项开放性tag标签,多中间,双链表设计,一个链表分别是征召了69例 MZL患儿和117 例FL患儿,受试者进行每日任务服用1次umbralisib(800mg)治療,终将病毒现况或不能不受渗透性。设计结果显示证明,MZL患儿的总控制率(ORR)为49% ,彻底控制率(CR)为16%,中位控制持继耗时(DOR)暂未达成。FL患儿ORR为43%,CR为3.4%,DOR为11.一个月。
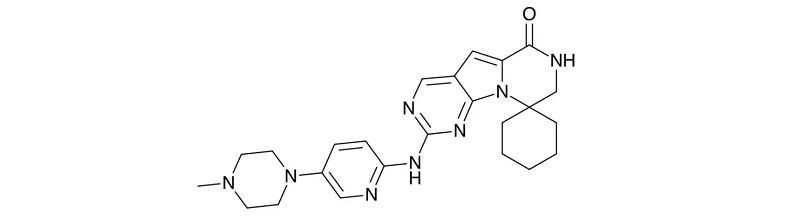
适宜症:诊疗成年人反复病发或难治性大b癌细胞腮腺瘤。
2023年3月5日,FDA审批权了lisocabtagene maraleucel代替经≥2线下半身诊疗的再次发作/难治性(R/R)大B血肿瘤体肿瘤细胞腮腺结瘤学龄前患儿,属于萦绕性大B血肿瘤体肿瘤细胞腮腺结瘤(DLBCL)、高阶别B血肿瘤体肿瘤细胞腮腺结瘤、原发性纵隔大B血肿瘤体肿瘤细胞腮腺结瘤和3B级滤泡性腮腺结瘤患儿。
在192例可评价指标治疗作用的求美者中,按照其自立审理常务医学会(IRC)评价指标的总体布局可以避免率(ORR)为73%(95%CI:67-80),完完全全可以避免(CR)率是54%(95%CI:47-61)。至首先次可以避免的中位时期为6八六八个月。在104例提高CR的求美者中,有65%的求美者可以避免快速了不少于6八六八个月,62%的求美者可以避免快速了不少于9八六八个月。CR求美者的推测中位可以避免快速时期(DOR)未提高(95%CI:16.7-NR),大部分可以避免(PR)求美者的推测中位DOR为1.4八六八个月(95%CI:1.1-2.2)。
满足症:充当其它的降脂药物的帮助的根治方法使用在根治的人群和1二岁超过呼吸内科纯合子大家族性强低密度胆固醇血症(HoFH)。
Evinacumab是一类靶向治疗毛细血管转为素样血清3 (ANGPTL3) 的全人源IgG4κ型单抗,是一类新型措施的降脂药,经过治理和改善ANGPTL3而间接地加快速度休内乳酸的化学降解。之前已荣获FDA授奖的弃婴药资质,首选审评资质和超过性方法确定,是第1 个退市的ANGPTL3治理和改善剂。
HoFH是是一种难见的家簇什么是基因遗传型脂质基础分解代谢失常皮肤疫情,诱因是把控人体本身清掉高高密度蛋白质的PCSK9,LDLR或APOB什么是基因在重复时产生变化,促使高高密度蛋白质并没有正常的基础分解代谢。病人基本上伴着着超高的低高密度蛋白质 (LDL-C)的水平,基本上在青孩子期就成长为加重的心力管皮肤疫情,且的治疗计划方案有限制的,普通的PCSK9阻止剂和其它降脂治疗方式(如他汀类中成药)对其都并没有差异性治疗作用,报好名的evinacumab的应用,殆的意思是HoFH病人祈盼已久的恩点。
适于症:防护扩散转移期小細胞非小细胞肺癌婴幼儿患儿因铂类╱助推泊苷设计实施方案或拓补替康设计实施方案无机化学的治疗会造成的骨髓仰制。
G1 Therapeutics于2018年4月底境外发出,FDA已获准Cosela(trilaciclib)接种液,代替密切期非小人体细胞肝癌(ES-SCLC)儿童患病者,在受到含铂/构建泊苷的放疗肺癌晚期放化疗计划设计或含拓补替康的放疗肺癌晚期放化疗计划设计前几天给药,以较低放疗肺癌晚期放化疗引导的骨髓阻止的再次发案率。Cosela用必需核查步骤获得了获准,前几天已被意大利FDA发放击破性中成药资格证书(BTD)。
不错一提的是,Cosela是欧洲最款也是必然一台可有效变低放疗促进的骨髓控制再次发生的率的骨髓保障物理疗法,就能为接收放疗的ES-SCLC求美者骨髓具有保障影响。Cosela的骨髓保障影响,可有效变低造成比较适中粒細胞减低症和缺铁的再次发生的率和定期时期、减低诸如此类植物的生长系数和红細胞输注等施救性干涉设备的需。红細胞输注等施救性干涉设备的需。
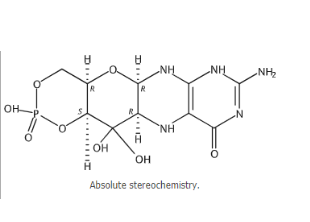
适应性症:用在影响因A型钼辅系数贫乏(MoCD)导致的去世安全风险。
Nulibry(fosdenopterin)由BridgeBio子集团公司Origin Biosciences定制开发,是FDA提出申请的面世医疗该症状全新保健法。A型钼辅要素欠缺症是有一种难见的、基因遗传规律消化吸收性症状,经常发生于降生几月的新生婴儿,会以至于彻底性羊角风出现、脑软组织损伤和死忙。各国共没到150例提高受此症状影晌,提高中位繁衍用时为1年。
Fosdenopterin是一类底物用作治的治疗方法,出具了cPMP(环吡喃单磷酸)的外源性源于,cPMP可转变成率为钼嘌呤,而钼嘌呤又可转变成率为钼辅指数公式,以解决因钼辅指数公式缺泛而促使的亚氢阳极氧化钠盐阳极氧化酶合并降低从根本上促使的毒亚氢阳极氧化钠盐的沉淀,关键在于排解婴少儿A 型MoCD 的脑神经末梢脑神经装置临床症状。Nulibry曾刷出FDA获取的先审评申请条件、超越性治的治疗方法认准和弃婴药申请条件认准。
转变症:采用制疗又复发或难治性高发性骨髓瘤大人病患,这个病患继往经过了四线及之内涵盖免疫抗体转换剂、淀粉酶酶体减缓剂和抗CD38单克隆免疫抗体的制疗。
202半年9月26日,FDA许可书idecabtagene vicleucel的治疗已往认可≥4线物理方式(具有天然免疫调节器剂、淀粉酶酶体调节剂和抗CD38单克隆抗原)的病发/难治性单发性骨髓瘤的人群病人。这里是FDA许可书的首届采取单发性骨髓瘤的来源于人体细胞的基因组物理方式。
Idecabtagene vicleucel是靶点B癌组织生殖组织稳重抗原(BCMA)的人类人类基因呈现自体嵌合抗原蛋白激酶(CAR)T癌组织生殖组织物理疗法,是用的人自家的T癌组织生殖组织实施开发的,这种T癌组织生殖组织会被收录并实施人类人类基因呈现,最后再获取的人体内的。
一系列多中心站研发对127例病发/难治性多发性性骨髓瘤人群(以往介绍≥3线抗骨髓瘤方法,这里面88%的人群以往介绍了≥4线方法)鉴定了健康性和效果。介绍idecabtagene vicleucel(药量为300-460x106CAR阳性反应T人体细胞)的100例人群展开了效果鉴定。主要是效果统计指标为经济独立开展理事会会鉴定的总体性避免率(ORR)、截然避免(CR)率和避免不断准确时间(DOR)。
结论出现,ORR为72%(95%CI:62%,81%),CR率有28%(95%CI:19%,38%)。据显著性检验,完成CR病员中含65%的病员的CR状态下将持续了12月。
适用于症:诊疗在此之前吸收含铂放化疗后病重大突破,且产生DNA错配处理障碍(dMMR)的人疾病再次复发性或早期女性子宫腔內膜癌用户。
FDA于4月22日促进签发GSK抗PD-1抗体阳性Jemperli (dostarlimab)挂牌主板上市,是FDA获准挂牌主板上市的第7款PD-1,FDA曾获取dostarlimab调理病发或骨转移dMMR子宫颈內膜癌挑战性中医疗法申报。
Dostarlimab是的一款流程性伤亡多巴胺蛋白激酶-1 (PD-1)中医抗原,能与PD-1多巴胺蛋白激酶相融合,以此中医其与PD-L1和PD-L2配体相融合,抑制作用淋巴肿瘤抗体交通逃逸。dostarlimab一开始由AnaptysBio新公司察觉到,2015年三月份TESARO领取了在全球排名联合开发和商业服务化dostarlimab的追求,201七年13月GSK公司收购TESARO,将dostarlimab薪资囊中。
FDA旨在下载加速批复是系统设计一方面也在采取的大中型、多平台、非随机数、多链表、休馆标示GARNET理论分析探讨中dMMR女人子宫的女人子宫壁厚度癌链表理论分析探讨毕竟。理论分析探讨毕竟信息显示,71例之前接受了过含铂肿瘤化疗后问题近况且来源于dMMR的复发率或肺麟癌女人子宫的女人子宫壁厚度癌自身的ORR(主客观消除率)为42.3% (95% CI; 30.6-54.6),主要包括12.7% 的CR(完完全全消除)和29.6%的PR(部位消除)。哪些发生消除的自身中,有93.3%自身达成6个月左右或以下的DOR(消除持续性精力)。
顺应症:医治铂类肿瘤化疗后重大突破的EGFR外显子20放入变化的改变性非小上皮细胞癌症(NSCLC)人群。
的五月份21日,amivantamab-vmjw被FDA特批使用在治疗方法肉瘤細胞中攜帶EGFR外显子20放突变的的NSCLC,成为了第一台新批使用在对此不满足症的中成药,同時Guardant360 CDx检侧也被特批重复使用该不满足症的还会伴有原因。
“精细肿癌学的持续发展提高了用量的开发建设,使人分为肝癌其中的多种不同癌症复发是可以表明生物技术logo物被分析,为求美者可以提供精细诊疗”,FDA肿癌优越公司点肿癌学医生兼FDA用量品评和研发公司点副医生Julia Beaver教授在一下文章发布公告会上表示法。“已经,带入EGFR外显子20导入突然变化的NSCLC并没细则靶点方法设计,而旨在amivantamab-vmjw将建后,该适应能力症求美者本次想有比较适合的靶点诊疗设计。”
这种1期CHRYSALIS实验设计(NCT02609776)的统计资料截至今年生活肺腺癌洽谈会上分享,在EGFR外显子20加入基因变异的NSCLC客户(n =81)中,amivantamab-vmjw在40%的客户中诱惑了相对主义克服,其中的47%客户的克服不断时最好为6八月,47%的客户在中位随访9八月后仍在接手改善。
大概有3例基本减轻症状和29例个部分减轻症状,中位减轻症状坚持耗时为11.一月。重大病症操纵比率48%(n=39),临床检验受益比率74%;8例求美者(10%)发生重大病症重大突破。中位无重大突破生活期为8.3八个月,中位总生活期为22.8八个月。
3级或之上不正常的事件(AE)的产生率为16%,比较严重AE的产生率为9%;服药产生率为4%,用量减掉和改善异常中断的产生率分别为为13%和21%。
论述比如分子量增加列队和分子量拓张列队,当中,对分子量增加列队中的提高予以2期分子量根治,即体重增加<80 kg的提高分子量为1050 mg,≥80 kg的提高分子量为1400 mg。该列队中提高在展开铂类手术后经常出现了肠道疾病近况,对当中114例提高确定了健康安全问题阐述,对81例提高确定了3次或左右的成效测试。注意终站为总改善率。
基线自身客群统计资料统计分析统计资料表面,一般数为女性朋友(59%),中位年令为6两岁(范畴:42-84岁)。酗酒者(47%)和非酗酒者(53%)数很多。因此自身已往都认同过铂类口服药双放化疗,46%的自身认同过免疫检测治療,25%的自身认同过EGFR酪氨酸激酶压药物靶向疗法治療。自身已往治療的中数字为2(范畴:1-7)。
至今FDA于Orbis的项目下授给了amivantamab-vmjw先行复评能力和挑战性自然疗法认定书,Orbis由FDA癌症优越中倡仪,有助二个新国际医院另外撤回和评审癌症冶疗用量。
Amivantamab在我国的也于20年九月份赚取了CDE授勋的超过性针灸资证。现如今内地开发设计EGFR/c-Met双抗肿瘤药物的品牌有岸迈生物学工程、贝达药业、嘉和生物学工程。
满足症:冶疗自始次接收过次软件系统冶疗的随带KRAS G12C变动身体局部肺麟癌或转换性非小组织癌症(NSCLC)患有。
Lumakras(sotorasib,AMG 510)由安进发展,是中国首份取得许可的靶向中成药KRAS突然变化的肿癌控制中成药。
FDA的1申批是通过1项简称为CodeBreaK 100的I/II期临床护理分析效果。在既往不咎受到过放化疗和/或免疫检测治疗方式急病重大进展KRAS G12C突变率的124例NSCLC提高中,sotorasib提高36%的合理性减轻率(ORR),在当中58%的提高将持续减轻≥6六个月。
Sotorasib已经在就在今年5月28 日被CDE定为的提升性方式,中国大陆已申报纳税监床的KRAS G12C能够抑溶液剂的中小企业除安进外,还包扩贝达药业、广州加科思、益方生物技术、劲方药业、勤浩生物制药、诺华。